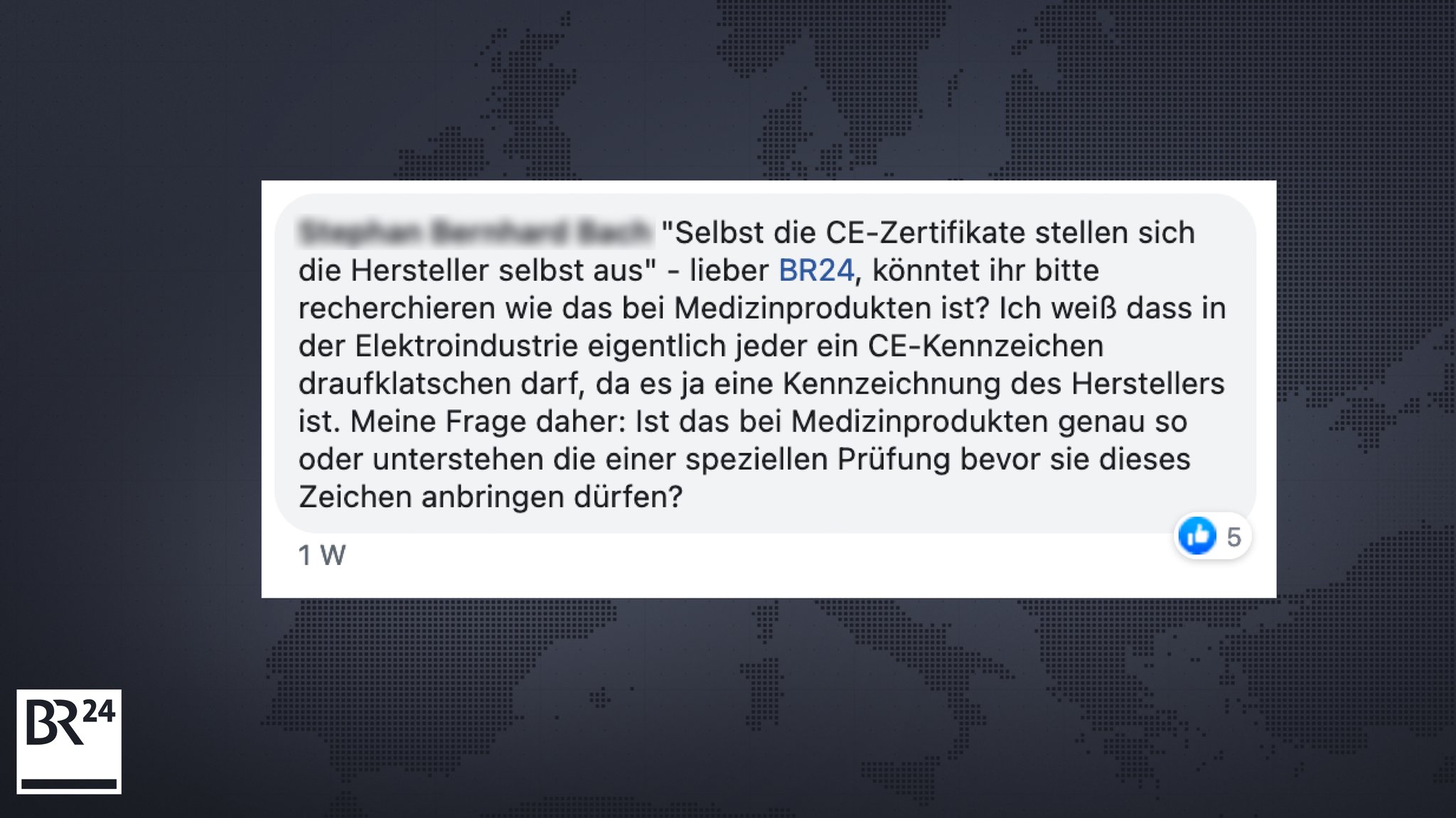
Um herauszufinden, ob jemand mit dem Coronavirus infiziert ist, werden oft Corona-Schnelltests eingesetzt. Kürzlich berichtete BR24, dass diese Antigen-Schnelltests kaum von einer unabhängigen Stelle überprüft werden. Die Hersteller von Antigen-Schnelltests dürfen sich die nötige CE-Konformitätserklärung, die besagt, dass ein Produkt grundlegende Sicherheits- und Leistungsanforderungen erfüllt, selbst ausstellen.
Ein Nutzer unserer BR24-Facebook-Seite wollte wissen, ob Medizinprodukte eine spezielle Prüfung benötigen, bevor sie das CE-Zeichen anbringen dürfen.
Nutzerfrage an BR24: Brauchen Medizinprodukte eine spezielle Prüfung
Ein Fall für den Faktenfuchs.
- Alle aktuellen Faktenfuchs-Artikel finden Sie hier.
Medizinprodukte müssen sicher sein
Wer in der EU ein Medizinprodukt auf den Markt bringen will, muss nachweisen, dass es den grundlegenden Sicherheits- und Leistungsanforderungen bzw. Normen entspricht.
Je nach Medizinprodukt sind diese grundlegenden Anforderungen in verschiedenen EU-Richtlinien festgehalten. Für In-Vitro-Diagnostika, zu denen Corona-Tests gehören, gibt es seit 1998 eine eigene Richtlinie, die sogenannte In-Vitro-Diagnostica Directive, kurz IVDD.
Wenn nun also ein Hersteller einen Corona-Test auf den Markt bringen will, muss er nachweisen, dass sein Produkt die Anforderungen der IVDD erfüllt. Das geschieht in einem sogenannten Konformitätsbewertungsverfahren.
Externe Prüfstellen kontrollieren die Qualität von Medizinprodukten
Welches Konformitätsbewertungsverfahren durchzuführen und in welchem Umfang dabei eine unabhängige Prüf- und Zertifizierungsstelle (Benannte Stelle) wie zum Beispiel der TÜV Süd zu beteiligen ist, hängt vom potentiellen Risiko der Produkte ab.
In-Vitro-Diagnostika sind in vier verschiedene Gruppen bzw. Risikoklassen eingeteilt. Corona-Tests zur Eigenanwendung fallen in die zweitniedrigste Risikoklasse. Corona-Tests, die wie die eingangs erwähnten Antigen-Tests von medizinischem Fachpersonal verwendet werden, fallen in die niedrigste Risikoklasse "Sonstige In-Vitro-Diagnostik".
Keine externe Kontrolle bei vielen Corona-Schnelltests
Nur für diese niedrigste Risikoklasse kann der Hersteller das Konformitätsbewertungsverfahren ohne Benannte Stelle durchführen. Er kann sich also selbst bescheinigen, dass sein Produkt funktioniert und sicher ist, und braucht das nicht von einer Prüfstelle wie dem TÜV Süd überprüfen lassen.
Für alle anderen In-Vitro-Diagnostika, also auch die Tests zur Eigenanwendung, muss die Qualitätskontrolle durch eine Benannte Stelle erfolgen.
Selbst-Tests müssen zertifiziert sein
Bei Corona-Schnelltests, die für die Eigenanwendung gedacht sind, achten Benannte Stellen zum Beispiel darauf, dass die Bedienungsanleitung so formuliert ist, "dass die Benutzer den Test korrekt und gefahrlos anwenden können", wie ein TÜV-Süd-Sprecher auf #Faktenfuchs-Anfrage schreibt.
Die Benannten Stellen überprüfen hier auch, ob die vom Hersteller gemachten Aussagen zu Sicherheit und Leistung den Tatsachen entsprechen. Dazu gehört auch der Nachweis der klinischen Leistung: Ist wissenschaftlich bewiesen, dass der beabsichtigte klinische Nutzen erreicht wird und das Produkt sicher ist?
Bei Corona-Schnelltests für die Eigenanwendung handelt es sich um Antikörper-Tests, also Tests, die herausfinden, ob das Immunsystem Antikörper gegen das Coronavirus gebildet hat. Antikörper-Schnelltests können nicht erkennen, ob eine Person gerade das Virus in sich trägt und andere anstecken kann. Das Bundesgesundheitsministerium warnt daher vor solchen Antikörper-Schnelltests.
Gefälschte Zertifikate bei Selbst-Tests
Antikörper-Schnelltests, die nicht mit Antigen-Tests zu verwechseln sind, werden im Internet angeboten. Da sie für die Eigenanwendung gedacht sind, benötigen sie eine Zertifizierung durch eine Benannte Stelle. Doch es gibt auch Hersteller, die diese Zertifikate fälschen, wie das Paul-Ehrlich-Institut, das Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, auf seiner Website schreibt. Auch wir haben bereits über einen solchen Fall berichtet.
Neue EU-Verordnung verschärft Zulassung von Corona-Tests
Ab Mai 2022 werden alle Corona-Tests durch eine Benannte Stelle überprüft werden müssen. Dann tritt die neue EU-Verordnung für In-Vitro-Diagnostika in Kraft (IVDR-Verordnung) und wird auch in Deutschland unmittelbar geltendes Recht.
Künftig werden In-Vitro-Diagnostika nach Regeln eingeteilt. Produkte, die übertragbare Erreger nachweisen - und dazu zählen alle Corona-Tests - werden ab 2022 der höchsten Risikokategorie D zugeordnet, wie es in den Klassifizierungsregeln der IVDR heißt.
Dadurch erhöhen sich auch die Anforderungen an die Qualitäts- und Sicherheitskontrolle von Corona-Schnelltests. Denn in Zukunft muss ein EU-Referenzlabor die Leistung der Tests überprüfen. "Die Ergebnisse des Referenzlabors müssen dann von der Benannten Stelle bei der Entscheidung zur CE-Kennzeichnung berücksichtigt werden", wie das Paul-Ehrlich-Institut auf seiner Website schreibt.
Sprich: Wer ab 2022 ein IVD-Produkt auf den Markt bringen will, muss es immer durch eine Benannte Stelle wie den TÜV prüfen lassen - und kann sich nicht mehr wie bislang selbst ein CE-Kennzeichen ausstellen. Ob in zwei Jahren noch Corona-Tests gebraucht werden, ist eine andere Frage. Allerdings können Hersteller ihre Corona-Tests schon jetzt von Benannten Stellen zertifizieren lassen, wenn sie wollen. Ab 2022 müssen sie es.
Fazit
Derzeit dürfen Hersteller Corona-Antigen-Schnelltests, die für die Verwendung durch medizinisches Fachpersonal gedacht sind, ohne externe Qualitätsprüfung auf den Markt bringen. Nur bei Antikörper-Schnelltests, die für Laien gedacht sind, muss eine Benannte Stelle wie zum Beispiel der TÜV Süd die Qualität kontrollieren. Ändern wird sich das 2022, wenn die neue EU-Verordnung für In-Vitro-Diagnostika in Kraft tritt. Dann müssen alle Corona-Tests eine externe Qualitätskontrolle durchlaufen.
"Darüber spricht Bayern": Der BR24-Newsletter informiert Sie immer montags bis freitags zum Feierabend über das Wichtigste vom Tag auf einen Blick – kompakt und direkt in Ihrem privaten Postfach. Hier geht’s zur Anmeldung!